Structural requirements of a glycolipid MPIase for membrane protein integration
Chemistry—A European Journal 29, e202300437 (2023).
Open access DOI: 10.1002/chem.202300437
藤川 紘樹1、Han Youjung2、大澤 月穂1、森 祥子1,3、野村 薫1、村本 真規2、西山 賢一2、島本 啓子1,3
1 公益財団法人サントリー生命科学財団 生物有機科学研究所
2 岩手大学農学部応用生物化学科
3 大阪大学大学院理学研究科化学専攻
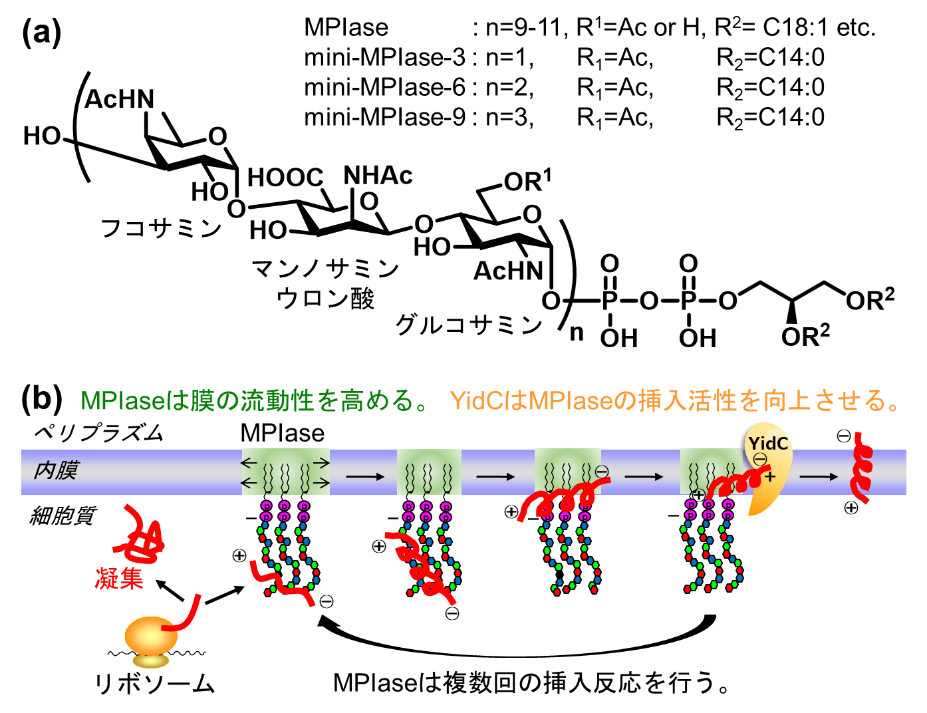
大腸菌の膜タンパク質が内膜に挿入する経路には、トランスロコン依存的に膜挿入され膜シャペロンYidCによって高次構造が整えられる経路と、小型のタンパク質がトランスロコンに依存せず自発的に挿入する経路の2種類が知られています。我々のグループは、大腸菌の内膜から、いずれの経路にも必須な非タンパク質性因子MPIase(Membrane Protein Integrase)を発見し、3糖単位の繰り返しから成る新規の糖ピロリン脂質である事を明らかにしてきました(図1a)。
本論文では、糖鎖長や官能基を改変したMPIase類縁体を単一かつ十分量合成する事で、分子・官能基レベルでの作用機構解明に取り組みました。複雑な糖脂質合成の課題を克服し、9糖ピロリン脂質(mini-MPIase-9)をはじめとする10種類以上の類縁体の化学合成に成功しました。均一な標品を用いた膜タンパク質膜挿入活性試験の結果、MPIaseに特徴的な官能基(アセチル基、カルボキシ基、ピロリン酸)や糖鎖長の活性への寄与や役割を明らかにする事ができました。合成類縁体を用いた構造活性相関研究を通して、大腸菌内膜におけるトランスロコン非依存型の膜タンパク質膜挿入として、MPIaseの糖鎖部が各官能基を介して基質タンパク質を捕まえ凝集を抑制し、ピロリン酸の強い負電荷で基質タンパク質を膜表面へと引き寄せ、MPIaseによって膜の流動性が高まった領域に挿入し、膜シャペロンYidCに引き渡す事でMPIaseの挿入活性が再生するというモデルを実証する事ができました(図1b)。